Syarat Reaksi Setara :
- Jumlah atom di ruas kanan = ruas kiri
- Jumlah muatan di ruas kanan = ruas kiri
- Jumlah elektron yang dilepas = yang ditangkap
Penyetaraan reaksi redoks :
1. Metode bilangan oksidasi
2. Metode setengah reaksi (ion-elektron)
- Tentukan unsur yang mengalami perubahan biloks
- Setarakan jumlah atom yang biloksnya berubah
- Tentukan perubahan biloks
- Samakan jumlah elektron yang dilepas dan ditangkap (kali dengan faktor pengali atau kali silang)
- Samakan muatan dengan cara :
- Suasana asam : Tambahkan H+ dan H2O
- Suasana basa : Tambahkan OH– dan H2O
- Cek jumlah atom O dan H
Contoh :
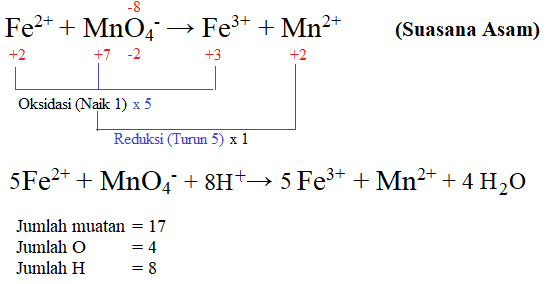
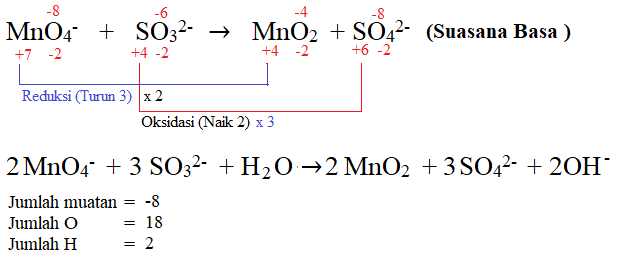
Metode Setengah Reaksi (Ion – Elektron)
- Tentukan unsur yang mengalami perubahan biloks
- Tulis reaksi oksidasi dan reduksi secara terpisah dalam bentuk ion
- Setarakan atom yang mengalami perubahan biloks
- Samakan jumlah O dan H dengan cara :
- Suasana asam : Tambahkan H2O di ruas yang kurang O, Tambahkan H+ di ruas lain
- Suasana basa : Tambahkan H2O di ruas yang lebih O, Tambahkan OH– di ruas lain
- Samakan muatan dengan menambahakan electron
- Setarakan jumlah electron yang terlibat (kali dengan factor pengali)
- Jumlahkan
Catatan :
Untuk penyetaraan dengan setengah reaksi, pada suasana basa dapat dilakukan dengan 2 cara :
- Tambahkan H2O di ruas yang lebih O, Tambahkan OH– di ruas lain
- Menyelesaikan penyetaraan reaksi dengan cara yang sama dalam suasana asam, kemudian tambahkan OH– di kedua ruas sebanyak H+ yang terpakai. Gabungkan H+ dan OH– menjadi H2O.
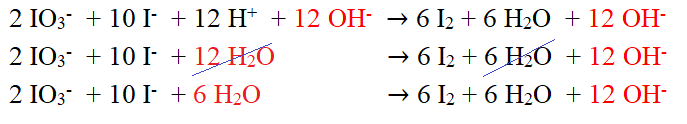
Contoh :
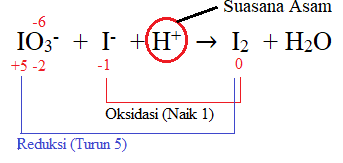
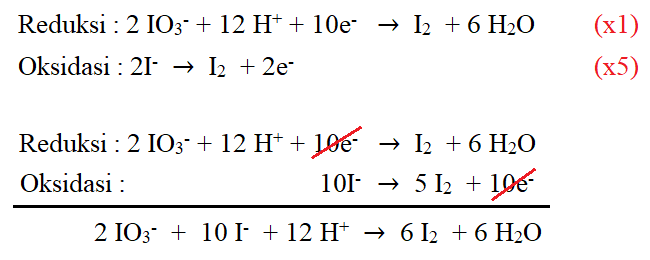
Dalam suasana Basa :
Elektrokimia : Cabang ilmu kimia yang memperlajari hubungan energi listrik dengan reaksi redoks. (Energi Kimia ↔ Energi Listrik)
Sel Elektrokimia :
- Sel Volta / Sel Galvani
- Sel Elektrolisis
Persamaan sel volta dan sel elektrolisis :
- Menggunakan elektroda : Katoda, anoda
- Menggunakan larutan elektrolit
- Melibatkan reaksi redoks

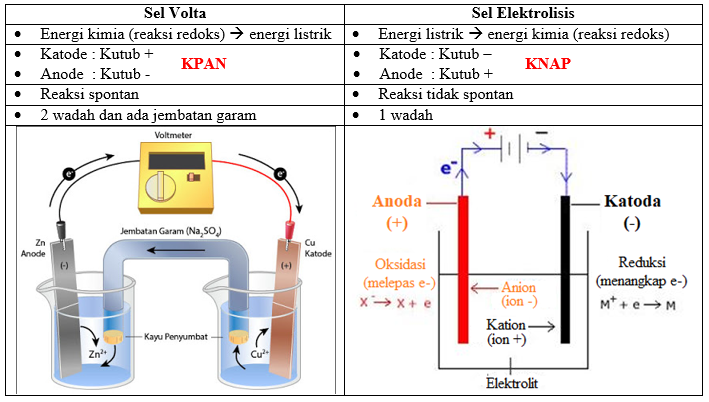
Perbedaan Sel Volta dan Sel elektrolisis :
SEL VOLTA / SEL GALVANI
Notasi Sel / Diagram Sel Volta : Zn(s) │Zn2+(aq) ║ Cu2+(aq) │Cu(s)
Aturan notasi sel :
- Garis ║ menunjukkan jembatan garam yang memisahkan reaksi di anoda dan katoda.
- Garis │ menunjukkan batas fasa yang berbeda
Notasi sel :
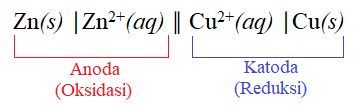
Reaksi redoks : Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
Cara Kerja Sel Volta :
- Elektroda Zn teroksidasi menjadi Zn2+ dengan reaksi : Zn(s) → Zn2+(aq) + 2e–
- Elektron yang dilepaskan mengalir melalui kawat penghantar menuju elektroda Cu.
- Pada elektroda Cu, e– diikat oleh ion Cu2+ dari larutan menjadi Cu. dengan reaksi : Cu2+(aq) + 2e–→ Cu(s)
- Akibatnya, Zn teroksidasi dan Cu2+ tereduksi. Pada anoda, ion Zn2+ lebih banyak dari ion SO42-, sedangkan pada katoda, ion SO42- lebih banyak dari ion Cu2+. Oleh sebab itu, ion SO42- berpindah dari elektroda Cu ke elektroda Zn melalui jembatan garam. Fungsi jembatan garam adalah untuk menyeimbangkan muatan.
- Pada akhir reaksi, berat elektroda Zn berkurang sedangkan elektroda Cu bertambah.
- Larutan CuSO4 semakin encer sedangkan larutan ZnSO4 semakin pekat.
Potensial Reduksi Standar (E⁰)
- Potensial listrik yang dihasilkan elektroda pada reaksi reduksi dalam keadaan standar (25⁰C, 1 atm)
- Makin BESAR E⁰ → Makin mudah tereduksi.
- Potensial unsur terhadap H2 : 2H+(aq) + 2e– → H2(g) E⁰ = 0 Volt
Potensial Sel (E⁰ sel)

Deret Volta / Deret Kereaktifan Logam
Li-K-Ba-Ca-Na-Mg-Al-Mn-(H2O)-Zn-Cr-Fe-Cd-Co-Ni-Sn-Pb-(H)-Cu-Hg-Ag-Pt-Au.
- Semakin ke kiri , E⁰ semakin KECIL, mudah teroksidasi (reduktor makin kuat)
- Semakin ke kanan, E⁰ semakin BESAR, mudah tereduksi (oksidator makin kuat)
SEL ELEKTROLISIS : Mengubah energi listrik menjadi energi kimia.
Reaksi Sel Elektrolisis :

Hukum Faraday
Hukum Faraday I :
“Massa zat yang dihasilkan pada elektrolisis (w) berbanding lurus dengan jumlah listrik yang digunakan (Q)”.
W ≡ Q Q = i.t
W ≡ i.t
Hukum Faraday II :
“Massa zat yang dihasilkan pada elektrolisis berbanding lurus dengan massa ekivalen (e)”.
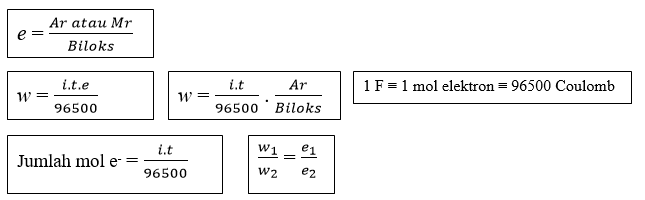
Keterangan :
w : massa zat hasil elektrolisis (gram)
Q : muatan listrik (Coulomb)
I : arus listrik (ampere)
t : waktu (detik)
e : massa ekivalen
F : Jumlah muatan listrik (Faraday)
Kegunaan Sel volta :
| Sel Volta | Keterangan |
| Baterai Kering / Sel Lecanche | · Tidak dapat diisi ulang · Anoda : Logam seng (Zn) yang dipakai sebagai wadah. · Katoda : Batang karbon (inert). · Elektrolit : Campuran berupa pasta yang terdiri dari C, MnO2, NH4Cl, dan sedikit air. |
| Baterai Alkaline | · Anoda : logam seng (Zn) digunakan sebagai wadah. · Katoda : oksida mangan (MnO2) · Elektrolit : kalium hidroksida (KOH) |
| Sel Aki | · Bersifat reversible (dapat diisi ulang) · Anoda : logam timbal (Pb). · Katoda : logam timbal (IV) oksida (PbO2). · Elektrolit : Larutan asam sulfat (H2SO4) encer. |
Korosi (Perkaratan Logam) : Proses oksidasi logam (Besi) oleh oksigen dari udara.
- Dalam peristiwa korosi, logam mengalami oksidasi sedangkan oksigen (udara) mengalami reduksi.
- Faktor yang mempercepat korosi besi : O2, H2O, Asam, Garam (Elektrolit), logam kurang aktif seperti Cu.
- Reaksi Korosi :
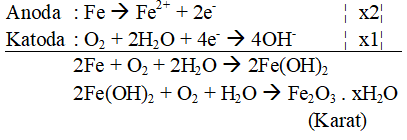
- Pencegahan Korosi :
- Pengecatan untuk mencegah kontak besi dengan O2 (udara) dan air.
- Melumuri dengan oli atau gemuk
- Dibalut dengan plastik.
- Tin plating (Pelapisan dengan timah) karena timah merupakan logam yang tahan karat. Pelapisan besi dengan timah akan melindungi besi dari korosi selama lapisan timah tersebut utuh.
- Cromium plating (pelapisan dengan kromium)
- Galvanisasi (pelapisan dengan zink)
- Pengorbanan anoda / perlindungan katoda
Logam yang digunakan : Mg, Al dan Zn (sebagai anoda) karena lebih aktif dari Fe (sebagai katoda)
#Oksidasi Al dan Zn (Al2O3 dan ZnO) kuat dan tahan terhadap korosi.